KIT基因不同突变类型的CBF-AML预后显著差异,含TKI治疗方案可有效逆转
KIT基因不同突变类型的CBF-AML预后显著差异,含TKI治疗方案可有效逆转 - 新闻中心 - 求臻医学
综述:BCOR/BCORL1 突变对急性髓系白血病患者异基因造血干细胞移植结局的影响 - 生物通
Lancet 重磅综述::急性髓系白血病(AML)诊断、临床表现与治疗
融合基因AML-ETO患者容易出现髓外白血病!治疗方案需注意这4点
文献精读 | 张曦、黄晓军、刘启发教授团队:MSCs移植后3个月序贯输注同时降低急/慢性GVHD发生
https://zhuanlan.zhihu.com/p/346034745 移植复发——哪些白血病容易复发?
EBMT 2022:陆道培医学团队造血干细胞移植相关研究成果分享 - 医院汇 - 丁香园
中位随访 32 个月(1~93 个月),所有患者均成功移植,供体完全嵌合。HSCT 术后的 3 年总生存率 (OS) 为 81.5%。119 例 CR1 患者中 65 例(54.6% 65/119)无 c-KIT 突变,54 例(45.4% 54/119)伴有 c-KIT 基因突变,前者 3 年 OS 优于有 c-KIT 组,但在统计学上无意义。(OS 89.5%vs.72.4%,p = 0.061)。
54 例有 c-KIT 基因突变中,21 例(38.9% 21/54)为 D816 位点突变,33 例(61.1% 33/54)非 D816 位点突变,非 D816 位点突变组的 3 年 OS 明显优于 D816 位点突变组,(OS 83.9%vs.54.7%,p = 0.024)。无 KIT 突变组与 KIT 非 D816 位点突变组 3 年 OS 相当(OS 89.5%vs.83.9%,p = 0.701)。死亡患者 18 例(15.1%),中位时间 10 个月(2-36 个月)。37.8%(45/119)患者发生 II-IV 级急性 aGVHD。16.8%(20/119)患者发生 III-IV 级 aGVHD。
结论:
异基因造血干细胞移植是治疗高危儿童急性髓系白血病伴 RUNX1-RUNX1T1 融合基因阳性患者的一种有效方法。
c-KIT(D816 位点)突变与儿童急性髓系白血病伴 RUNX1-RUNX1T1 融合基因阳性患者的不良预后密切相关。
本文回顾性分析了COG AAML 0531研究中患者KIT基因不同突变亚型对核心结合因子相关急性髓细胞白血病(CBF-AML)患者的预后影响,该研究使用CD33抗体药物偶联剂Gemtuzumab Ozogamicin(GO)治疗方案。结果表明,KIT突变对CBF–AML有着显著不良影响,以17外显子突变为主,含有GO和酪氨酸激酶抑制剂(TKI)的方案治疗可改善17外显子突变高危患者的预后。
研究背景
核心结合因子相关急性髓细胞白血病(CBF-AML)是急性髓细胞白血病(AML)中较常见的细胞遗传学亚型,约占AML总数的15%,该病包括2种遗传学表型:一种为t(8;21)(q22;q22),累及编码核心结合因子(CBF)α亚单位,临床以AML-M2b亚型多见;另一种为t(16;16)(p13.1;q22)或倒位inv(16)(p13.1q22),累及编码核心结合因子CBFβ亚单位,临床以AML-M4EO亚型多见。CBF-AML占儿童急性髓细胞白血病(AML)的20~30%,但并非所有患者可以获得很好的治疗效果,预后差异显著,需进一步风险分层以改善临床疗效。
KIT原癌基因编码跨膜糖蛋白Ⅲ型受体酪氨酸激酶(RTK),KIT突变在多种肿瘤发生发展中有重要作用,突变多发生于影响RTK活性的关键区域,如11外显子JMD区或酪氨酸激酶区(TKD),导致配体非依赖性激活。携带KIT突变的肿瘤中,酪氨酸激酶抑制剂(TKI)对异常激活的KIT有抑制作用,是某些KIT突变疾病的一线治疗方法。KIT突变在CBF-AML中很常见,t(8;21)中发生率12%~46%,inv(16)中9%~53%。目前报道的在不同的临床研究中,KIT突变对 CBF-AML的预后影响结论存在争议。
研究方法
包含细胞学研究和临床队列研究,细胞学研究将KIT第17外显子(E17)和第8外显子(E8)突变的载体转染HEK293和Ba/F3细胞后,观察TKI治疗条件下KIT磷酸化、细胞因子非依赖性生长的反应。COG AAML 0531研究中接受GO治疗的患者,根据突变状态(KIT+与野生型KIT)和不同突变部位(E8 和E17)做分类,评估患者治疗结果。
研究结果
63/205(31%)患者检测到KIT突变(图1),22例(35%)为E8突变,32例(51%)为E17突变,6例(10%)二者均发生突变,3例(5%)突变发生在其他外显子。细胞学功能研究表明,只有E17突变才会导致异常KIT磷酸化和细胞生长。TKI暴露显著抑制E17突变细胞生长,而对E8转染细胞生长无影响(图2)。KIT+CBF-AML患者的总体生存率(OS)与KIT野生型组相似(78%和81%,p=0.905),但复发率较高(RR分别为43%和21%,p=0.005)(图3)。尽管GO可以消除不良预后影响,但E17 KIT+患者结果差于KIT野生型患者[无病生存率(DFS)51%和73%,p=0.027,RR为21%和46%,p=0.007)](图4)。E8突变无明显预后作用,GO不能显著改善其预后(图5)。
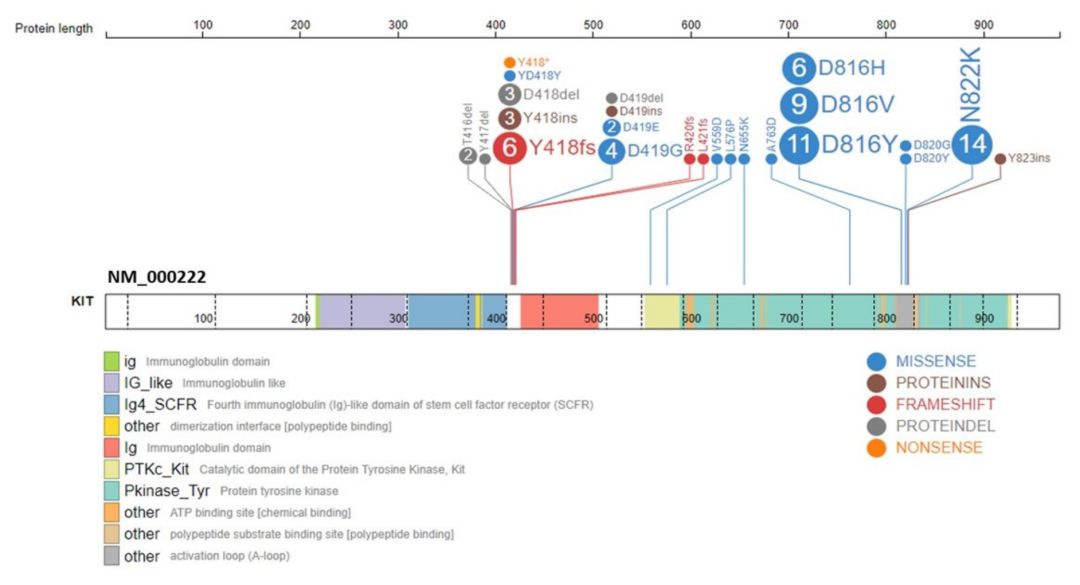
图1 采用靶向捕获测序方法检测CBF-AML的KIT突变,突变常发生于8及17外显子,分别为免疫球蛋白胞外区域和酪氨酸激酶结构域的一部分。检测到的突变包括单核苷酸变异(SNVs)及小片段缺失,大部分为框内改变,虚线表示外显子边界。
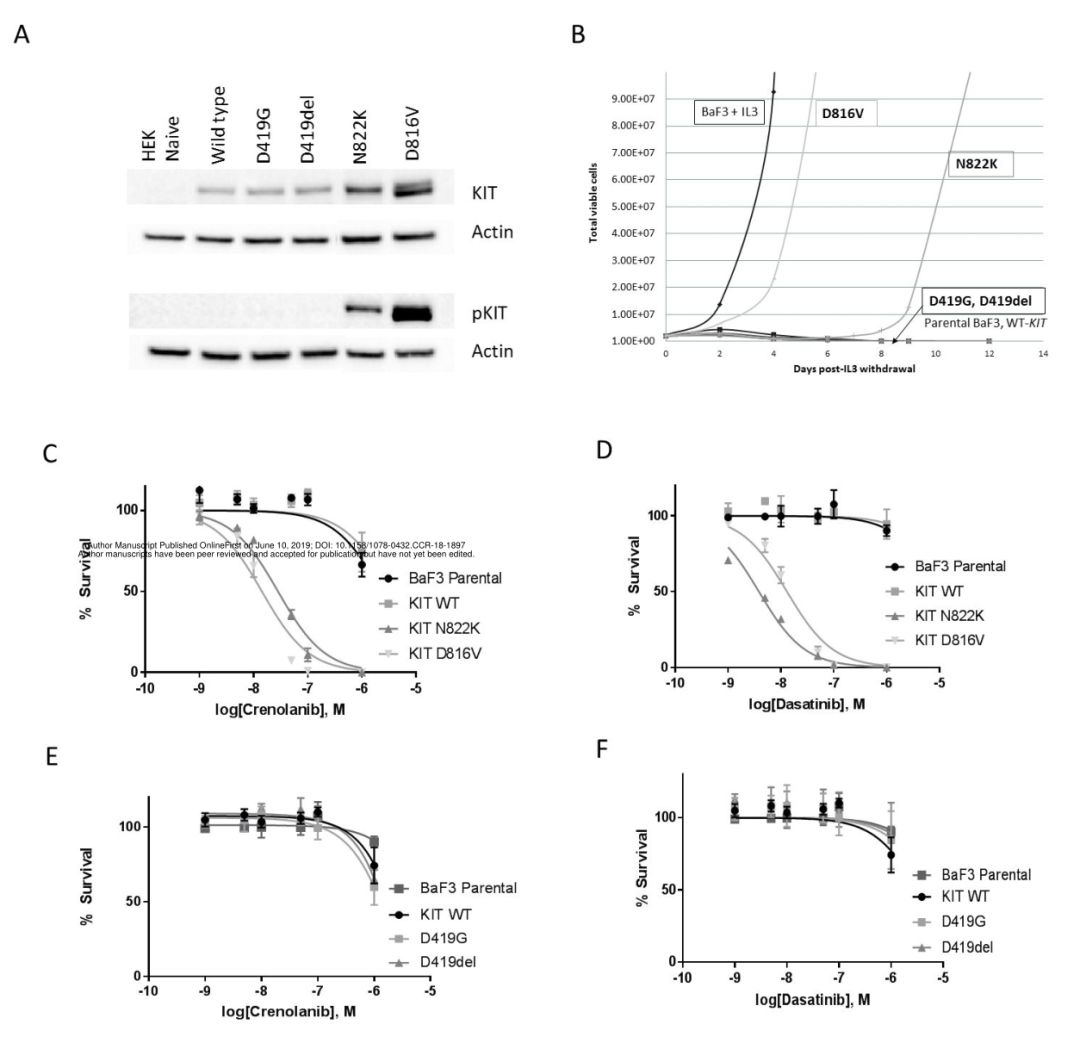
图2 KIT的8号外显子和17号外显子突变的体外功能评价。(A)外显子8(D419G,D419del)和17(D816V,N822K)突变转染HEK293细胞后,KIT磷酸化;(B)Ba/F3细胞系中IL3撤除实验证实E17 D816V和N822K突变的转化潜能;(C)crenolanib对D816V和N822K转染Ba/F3细胞的细胞毒作用;(D)达沙替尼对D816V和N822K转染Ba/F3细胞的细胞毒作用;(E)crenolanib对D419del和D419G转染Ba/F3细胞的细胞毒作用;(F)达沙替尼对D419del和D419G转染Ba/F3细胞的细胞毒作用
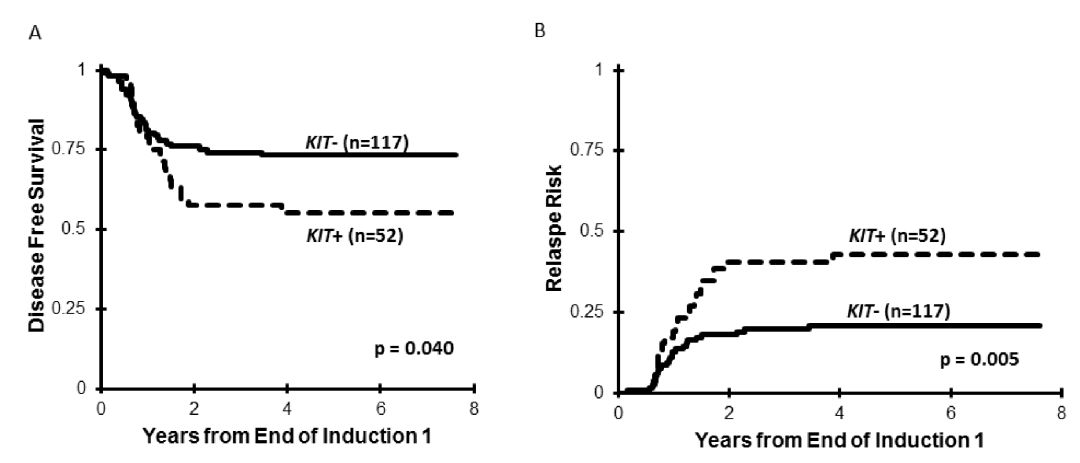
图 3(A)根据KIT突变状态,CBF AML患者的无病生存;(B)根据KIT突变状态,CBF AML患者的复发风险
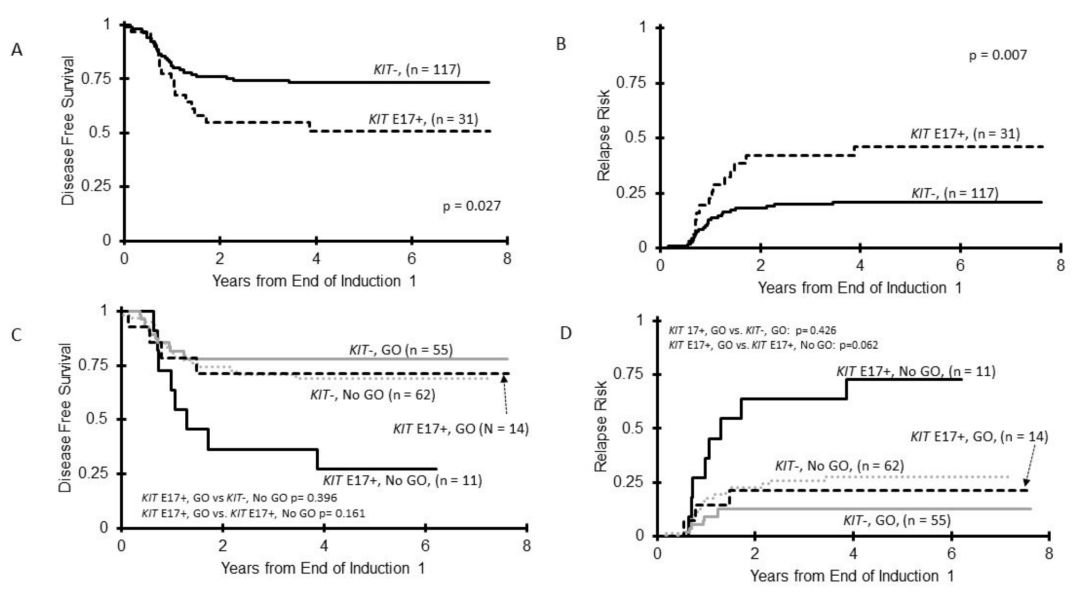
图4 E17突变与CBF-AML临床结局的关系。(A)KIT+与KIT野生型 患者的DFS比较(B)KIT+与KIT野生型患者的RR比较;(C)E17+与KIT野生型患者采用含有GO和不含GO治疗时的的DFS;(D)E17+ 与KIT野生型患者采用含有GO和不含GO治疗时的RR
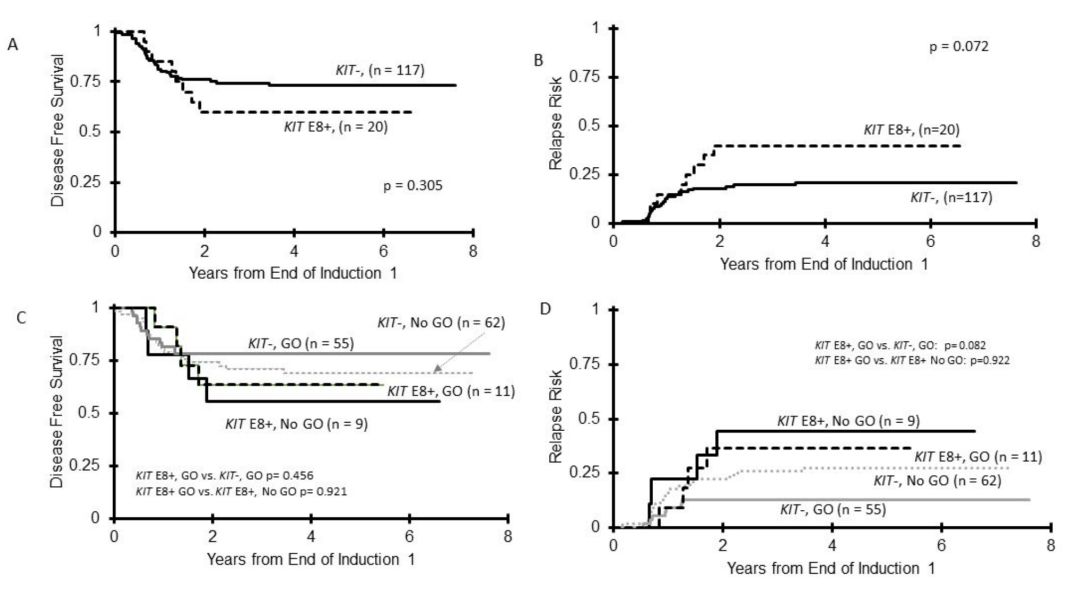
图5 E8突变与CBF-AML临床预后的关系。(A)E8+CBF与KIT野生型患者的DFS比较;(B)E8+CBF与KIT野生型患者的RR比较;(C)E8+与KIT野生型患者采用含GO和不含GO方案治疗时的DFS;(D)E8+与KIT野生型患者采用含GO和不含GO方案治疗时的RR
讨论
在这项回顾性研究中,分析研究了205名儿童CBF-AML的KIT突变发生率和预后影响,KIT突变发生率31%,总体上较差KIT+与EFS和DFS以及RR升高相关,不良预后主要与E17突变相关。在GO治疗下,E17+患者临床疗效与KIT-者相似,倾向于使E17+疾病复发减少,OS、EFS和DFS改善,GO治疗可克服E17+导致的不良预后;未接受GO治疗患者中,E8+患者临床疗效和KIT-疾病结果相似,E8+可能对预后无影响。细胞学研究发现E17突变导致KIT信号自主激活,对TKIs的细胞毒作用敏感。
以往的其他临床研究中,可能由于使用的治疗方案和治疗强度不一致,没有发现儿童CBF-AML中KIT突变的预后参考价值。这项研究中采用了统一的治疗方案,研究首次表明,患者可从GO治疗中获益,特别是对E17+患者。这项研究中使用了标准的化疗方案,对发现KIT+疾病结果的不同有帮助,而且研究队列较大,可以根据KIT突变位置进一步分析结果差异。
这项研究结果支持既往研究结论,使用GO治疗患者中,KIT+和KIT野生型患者疗效相似,E17+患者最为明显,提示KIT+的CBF-AML不良结果可以通过适当强化治疗克服,而无需使用HSCT。这项研究提供了KIT+CBF AML临床结果差异的生物学基础,证明了E17异常活化的临床意义,同时提示D816突变对预后影响最大。因研究中复发患者人数太少,无法明确KIT突变克隆性在初诊和复发时的动态变化。
这项研究还表明,E17突变导致KIT异常磷酸化和肿瘤生长,其中D816V比N822K具有更强的作用,转染D816V的细胞可导致更高水平的不成熟KIT在胞内滞留并磷酸化。虽然17、8和11外显子突变患者较野生型患者可检测到更高的不成熟KIT水平。但E17突变对TKI敏感,Crenolanib和达沙替尼能诱导E17转导细胞凋亡,与其他体外研究一致,支持E17突变作为AML治疗靶点,而E8突变不影响功能且对TKIs的细胞毒作用不敏感。11外显子突变也可导致异常磷酸化,但程度不及E17突变且不会产生转化影响,但也可采用TKI治疗,这在许多实体瘤中已有验证。体外研究结果表明,E17和E11突变患者应进一步研究采用TKI强化治疗。
KIT突变AML对TKIs的反应可能由多种机制介导,异常激活的KIT基因信号通路可能是重要的TKIs靶点,如D816V突变,导致未成熟细胞内KIT磷酸化是胃肠道间质瘤常见激活机制,伊马替尼治疗可阻断KIT基因突变造成的磷酸化并促使蛋白成熟。目前有研究正在评估TKIs在KIT+ CBF-AML中的作用,TKIs可能成为重要的强化治疗策略。
点评
二代测序可明确各种致癌基因的多种突变形式,对了解基因功能、临床疗效及预后和克隆性的关系很有帮助。这项研究正是通过测序研究明确了KIT突变与CBF AML不良预后相关,影响主要源于E17+突变。同时亦明确并非所有KIT突变都适用TKI治疗,因此很有必要明确不同RTK突变的功能意义以指导靶向治疗的选择,进一步改善患者预后。
急性髓系白血病(AML)中的 KIT 突变:分子机制、临床意义与靶向治疗
一、KIT 基因与蛋白的生物学功能
KIT 基因定位于染色体 4q12,编码 Ⅲ 型受体酪氨酸激酶(KIT 蛋白),属于干细胞因子受体(SCFR)。其结构与功能包括:
- 结构域:胞外配体结合区(Ig 样结构)、跨膜区、胞内酪氨酸激酶结构域(TKD,含激活环 A-loop)。
- 信号通路:
- 配体(干细胞因子,SCF)结合后诱导 KIT 二聚化,激活胞内酪氨酸激酶,磷酸化下游信号分子(如 PI3K-AKT、RAS-MAPK、JAK-STAT);
- 调控造血干细胞增殖、分化、存活及迁移,尤其在肥大细胞、黑素细胞和生殖细胞发育中起关键作用。
二、AML 中 KIT 突变的发生率与分子特征
-
整体发生率:
- 在 AML 中总突变率约 5%-10%,但在特定亚型中显著升高:
- 核心结合因子 AML(CBF-AML):
- RUNX1-RUNX1T1(t (8;21))阳性 AML:KIT 突变率 20%-30%;
- CBFB-MYH11(inv (16)/t (16;16))阳性 AML:突变率 10%-20%;
- 其他亚型:伴 NPM1 突变的 AML(约 5%)、伴 FLT3-ITD 突变的 AML(约 8%)。
- 核心结合因子 AML(CBF-AML):
- 在 AML 中总突变率约 5%-10%,但在特定亚型中显著升高:
-
突变类型与热点区域:
- 激活型突变:多为错义突变或插入 / 缺失,导致 KIT 蛋白组成型激活(不依赖 SCF)。
- 热点区域:
- exon 17(TKD 区):如 D816V 突变(类似肥大细胞增多症中的突变),占 AML 中 KIT 突变的 40%-50%;
- exon 8(胞外 Ig 样结构域):如 N526K、Y578H 突变,常见于 CBF-AML,与不良预后相关;
- exon 11(胞外区):较少见,多见于伴 NPM1 突变的 AML。
三、KIT 突变在 AML 中的临床与预后意义
-
对 CBF-AML 预后的影响:
- 传统认知:CBF-AML 曾被认为预后良好,但 KIT 突变显著逆转这一趋势:
- RUNX1-RUNX1T1+KIT 突变:5 年总生存率(OS)从 60%-70% 降至 40%-50%,复发风险增加 2-3 倍;
- CBFB-MYH11+KIT 突变:OS 从 70%-80% 降至 50%-60%,且对大剂量阿糖胞苷巩固治疗反应减弱。
- 机制:KIT 突变激活 PI3K-AKT 通路,促进白血病干细胞(LSC)自我更新,增强化疗耐药性。
- 传统认知:CBF-AML 曾被认为预后良好,但 KIT 突变显著逆转这一趋势:
-
与其他基因异常的共存:
- FLT3-ITD:约 30% 的 KIT 突变 AML 同时携带 FLT3-ITD,进一步恶化预后(OS<30%);
- NPM1 突变:KIT 突变与 NPM1 突变共存时,对预后的影响存在争议,可能与突变位点相关(如 exon 17 突变影响更显著)。
四、KIT 突变 AML 的靶向治疗策略
-
第一代 KIT 抑制剂:伊马替尼
- 作用机制:竞争性结合 KIT 激酶结构域的 ATP 结合位点,抑制磷酸化。
- 临床数据:
- 对 exon 11 突变疗效最佳(缓解率约 50%),对 exon 17 突变(如 D816V)几乎无效(因突变导致 ATP 结合口袋构象改变);
- 在 CBF-AML 中的应用:
- 日本 JFICG 研究显示,伊马替尼联合化疗用于 RUNX1-RUNX1T1+KIT 突变患者,3 年无事件生存率(EFS)从 38% 提升至 55%;
- 推荐用于巩固 / 维持治疗,剂量 400-600 mg/d。
-
第二代抑制剂:舒尼替尼、索拉非尼
- 优势:对 exon 17 突变(如 D816V)亲和力更高,且抑制多靶点(如 VEGFR、PDGFR)。
- 临床证据:
- 舒尼替尼:单药治疗 KIT 突变 AML 的客观缓解率(ORR)约 20%-30%,与化疗联合可提高至 40%-50%;
- 索拉非尼:在一项 Ⅱ 期试验中,联合阿糖胞苷用于 CBF-AML+KIT 突变患者,2 年 EFS 达 62%,优于单纯化疗组(45%)。
-
第三代高选择性抑制剂:阿伐替尼(Avapritinib)
- 特异性:针对 D816V 等难治性突变,IC50 低至 nM 级。
- 临床试验:
- NCT02560533 试验显示,阿伐替尼单药治疗 KIT D816V 突变 AML 的 ORR 为 35%,其中完全缓解(CR)率 15%;
- 推荐剂量 300-400 mg/d,常见不良反应为血小板减少和贫血。
-
联合治疗策略
- KIT 抑制剂 + 化疗:
- 伊马替尼联合柔红霉素 + 阿糖胞苷(DA 方案):一项 Ⅲ 期试验显示,可使 KIT 突变 CBF-AML 的 CR 率从 68% 提升至 82%;
- KIT 抑制剂 + 去甲基化药物:
- 阿扎胞苷联合舒尼替尼用于老年 KIT 突变 AML,ORR 达 45%,适用于不适合强化疗的患者;
- KIT 抑制剂 + BCL-2 抑制剂:
- 维奈克拉联合阿伐替尼可协同诱导凋亡,临床前研究显示对 LSC 杀伤作用增强。
- KIT 抑制剂 + 化疗:
五、耐药机制与应对策略
-
原发性耐药:
- 突变位点影响:exon 17 D816V 对伊马替尼耐药,需直接选用阿伐替尼;
- 旁路信号激活:如 PI3K-AKT 通路异常(PTEN 突变)可绕过 KIT 抑制。
-
获得性耐药:
- 二次突变:如 KIT exon 17 出现 F823L/V 突变,或 exon 18 出现开关区突变(如 V654A),导致药物结合力下降;
- 解决方案:
- 序贯使用不同代次抑制剂(如伊马替尼→舒尼替尼→阿伐替尼);
- 联合 MEK 抑制剂(如曲美替尼)阻断 RAS-MAPK 旁路激活。
六、临床实践建议与未来方向
-
检测标准:
- 所有 CBF-AML 患者应常规检测 KIT 突变(尤其是 exon 8 和 17),采用二代测序(NGS)或实时定量 PCR;
- 复发患者需重新检测 KIT 突变状态,排除耐药突变。
-
分层治疗推荐:
突变类型 危险分层 推荐治疗方案 RUNX1-RUNX1T1+KIT 野生型 低危 大剂量阿糖胞苷巩固,无需维持治疗 RUNX1-RUNX1T1+KIT 突变 中危 伊马替尼联合化疗,缓解后伊马替尼维持 CBF-AML+KIT D816V 突变 高危 阿伐替尼联合化疗,考虑异基因造血干细胞移植(allo-HSCT) -
未来研究方向:
- 双特异性抗体:靶向 KIT+CD3 的 BiTE 抗体(如 AMG 224)正在临床试验中,可增强 T 细胞对 KIT 阳性白血病细胞的杀伤;
- 表观遗传调控:KIT 突变 AML 中常伴随 DNMT3A 突变,联合去甲基化药物(如地西他滨)可能逆转耐药;
- 精准模型指导:利用类器官或 PDX 模型筛选个体化 KIT 抑制剂,提高治疗响应率。
七、总结
KIT 突变是 AML 中重要的分子异常,尤其在 CBF-AML 中显著影响预后。随着新一代 KIT 抑制剂(如阿伐替尼)的临床应用,结合精准分层治疗和联合策略,KIT 突变 AML 患者的生存已得到改善。未来,需进一步明确耐药机制,开发更具特异性的靶向药物,并探索与免疫治疗、表观遗传药物的联合模式,以实现 “精准靶向 KIT 突变 + 清除 LSC” 的治疗目标。

DAMO开发者矩阵,由阿里巴巴达摩院和中国互联网协会联合发起,致力于探讨最前沿的技术趋势与应用成果,搭建高质量的交流与分享平台,推动技术创新与产业应用链接,围绕“人工智能与新型计算”构建开放共享的开发者生态。
更多推荐
 已为社区贡献5条内容
已为社区贡献5条内容







所有评论(0)