医疗器械注册审评查询-器械研发调研必备数据库
检索页面显示受理号、产品名称、产品一二三级目录分类、注册证编号、申请类型、申请内容、审评结论、企业名称、企业所在省份、代理人、批件发布日期、批准日期、管理类别、国产/进口、是否医保、医保医用耗材代码、审评报告、优先审评、创新特别审查、临床试验模式许可、临床意见审批单等字段内容显示。申请内容——申请上市、申请临床试验、申请产品注册、申请出口、申请变更、申请复审、申请委托生产、申请延续注册、申请注册指
中国器械审评是中国医疗器械注册上市的必经程序,包含注册申报资料准备、上市前审评审批、上市后审评管理三大阶段。在申请人提交注册申请后,只有通过形式审查或立卷审查,符合受理要求拿到受理号才能进行相关数据查询。
那若拿到受理号,又如何进行医疗器械注册审评进度查询呢?有哪些网站平台推荐呢?今天就来盘点一下中国器械审评查询相关网站及方法!
国家局器械产品进度查询:器械审评中心
数据
国产第三类、进口医疗器械产品的技术审评;国产第三类、进口医疗器械变更注册和延续注册的行政审批、第三类高风险医疗器械临床试验审批决定。
检索
需提供受理号、受理日期、申请单位、数据校验码进行精确查询
在“中国器审”公众号“企业服务”栏下点击“进度查询”或在器审中心网站“办事大厅”栏下点击“审评进度查询”输入受理号等信息即可查询本单位申报产品的审评进度。
在“中国器审”公众号“企业服务”栏下点击“产品跟踪”按要求绑定企业信息和产品后,产品审评环节变化时可以通过微信收到主动推送的状态变化通知。
全国器械产品进度查询及器械审评数据分析应用:数屿医械
数据
数屿医械中国器械审评数据库收录国家药品监督管理局(NMPA)与国家药品监督管理局医疗器械技术审评中心(CMDE)等多个官方部门的受理信息,每日实时更新。
补充了2003年以来的历史数据,弥补了官网没有历史数据的缺陷,总数据量20W+。
同时,该数据库群还以临床试验数据、优先审批、临床试验备案、创新医疗器械、地方第二类医疗器械注册信息作为补充,是掌握国内器械注册信息的有利工具。
检索
单一查询:受理号、产品名称、编号、申请人,提供4种精确查询。
范围查询:
时间范围——近1周、近1月、近3月、近6月、近一年、自定义时间
分类范围——支持一级分类、二级分类、三级分类筛选查询。
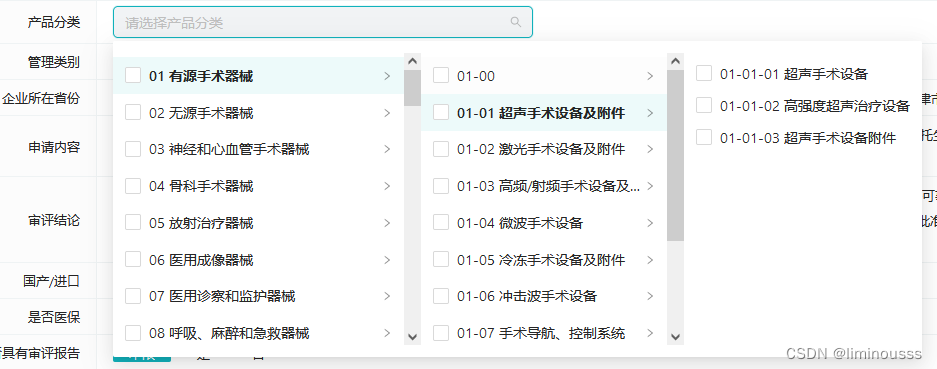
地址范围——支持34个省级行政区范围筛选
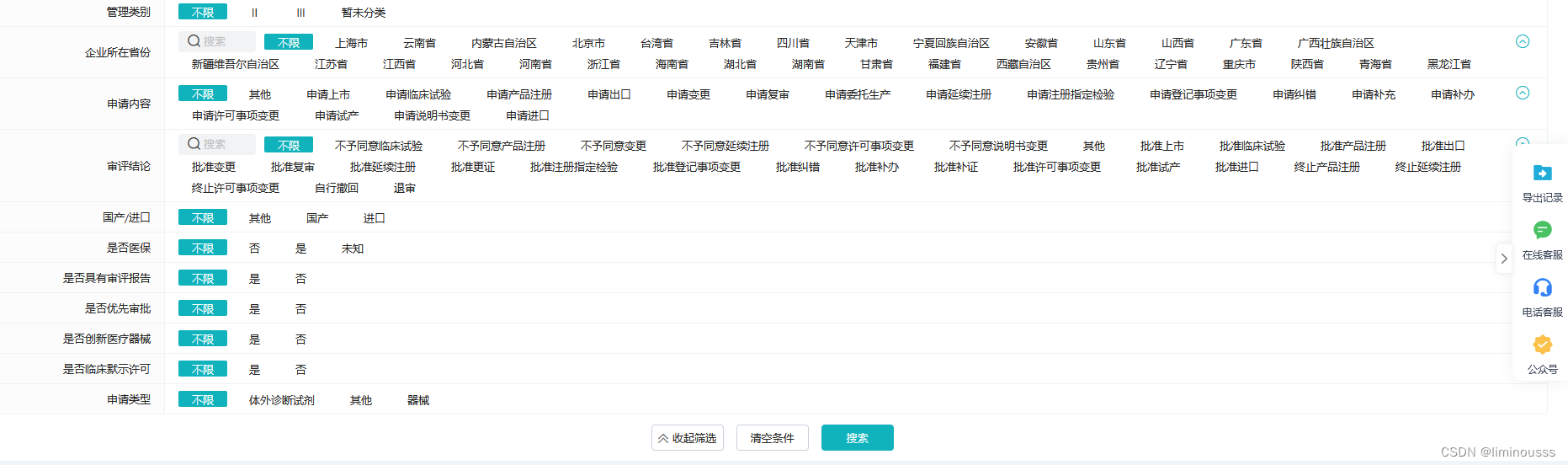
条件组合:
可通过申请内容、审评结论及管理类别、国产/进口、医保、审评报告、优先审评、创新特别审查、临床试验模式许可、申请类型进行任意组合,进行批量查询。
申请内容——申请上市、申请临床试验、申请产品注册、申请出口、申请变更、申请复审、申请委托生产、申请延续注册、申请注册指定检验、申请登记事项变更、申请纠错、申请补充、申请补办、申请许可事项变更、申请试产、申请说明书变更、申请进口
审评结论——不予同意临床试验、不予同意产品注册、不予同意变更、不予同意延续注册、批准上市、终止产品注册、自行撤回、退审等28项结论类型
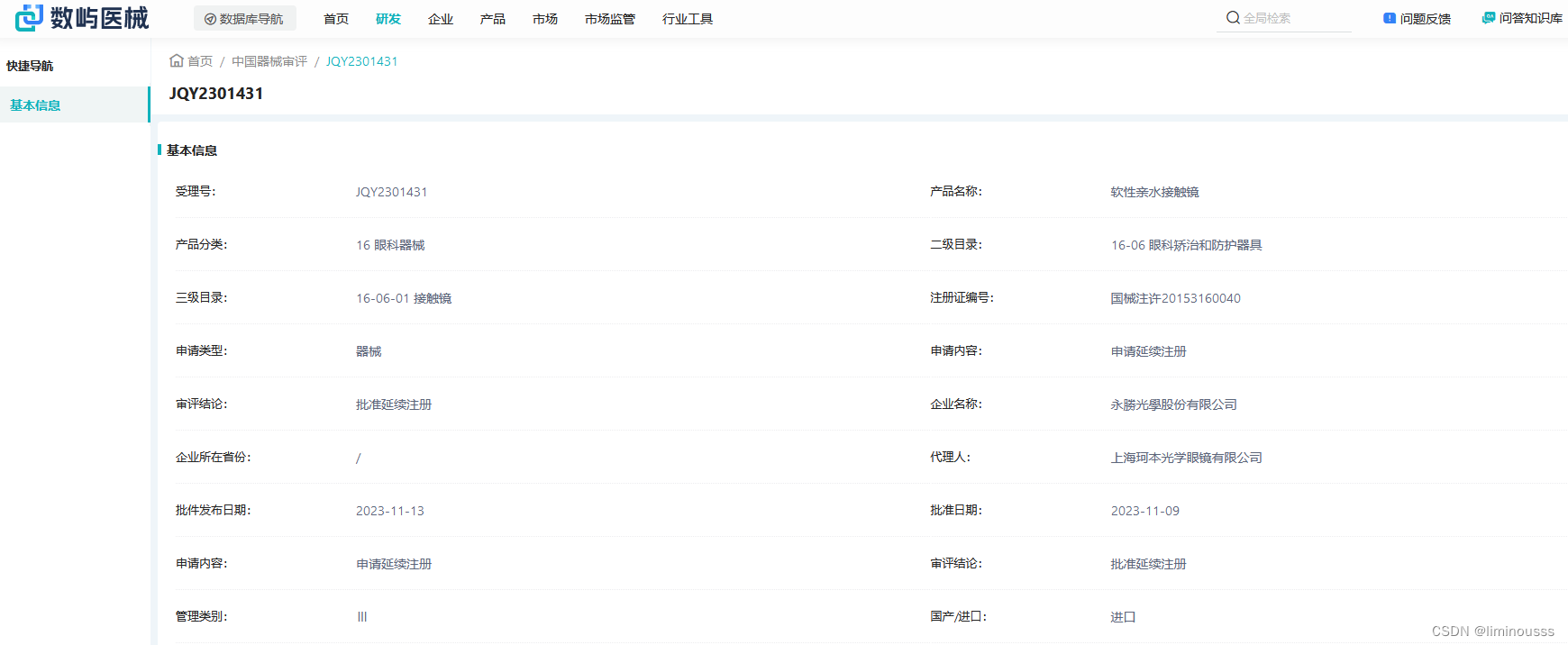
3.结果显示
检索页面显示受理号、产品名称、产品一二三级目录分类、注册证编号、申请类型、申请内容、审评结论、企业名称、企业所在省份、代理人、批件发布日期、批准日期、管理类别、国产/进口、是否医保、医保医用耗材代码、审评报告、优先审评、创新特别审查、临床试验模式许可、临床意见审批单等字段内容显示。
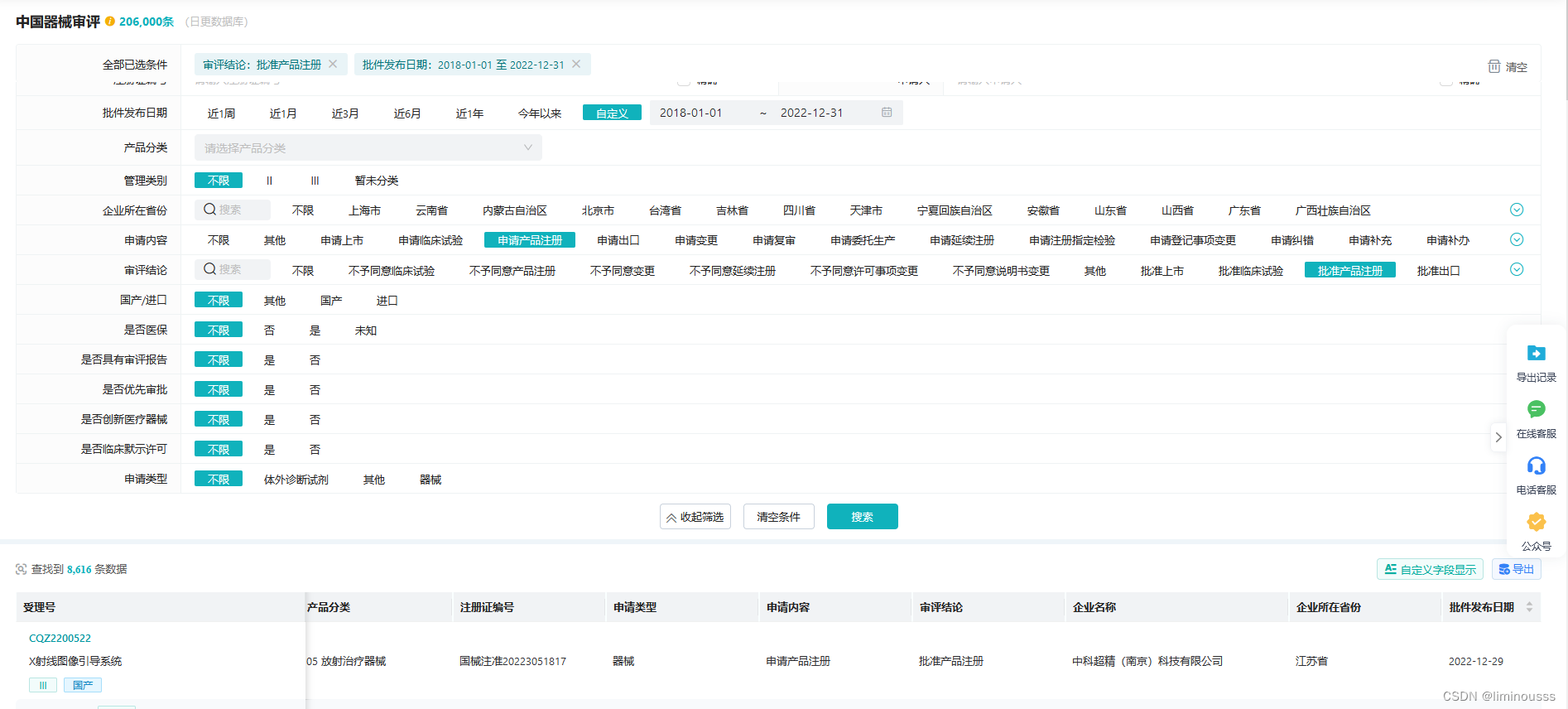
数屿医械中国器械审评数据库除了审评进度基础查询外,还提供数据分析、数据关联流转等功能,在应用场景这块具有较大优势。用户不仅可以通过数据库快速查询目标产品的审评情况,还可以通过系统综合分析,实时跟踪器械研发进展,掌握研发趋势,给企业科学立项、器械产品销售策略提供数据支持。
如:2018年至2022年全国医疗器械获得产品注册批准数量共有8616项,其中国产5643项,进口2973项。从地区看,北京市1465项,上海市1085项,广东省878项,更多数据统计分析,可自行查询。
以上便是中国医疗器械审评进度及相关信息查询网站及方法,大家可根据需求具体选择。
附中国医疗器械审评相关文件(部分)
1.医疗器械分类
- 《医疗器械分类规则》(国家食品药品监督管理总局令第15号)
- 《医疗器械分类目录》(2017年第104号)
- 国家药监局关于调整《医疗器械分类目录》部分内容的公告(2020年 第147号)
- 国家药监局关于发布第一类医疗器械产品目录的公告(2021年第158号)
- 国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第25号)
- 国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第30号)
- 国家药监局关于医用透明质酸钠产品管理类别的公告(2022年第103号)
- 国家药监局关于调整《医疗器械分类目录》部分内容的公告(2023年第101号)
2.体外诊断试剂分类
- 国家药监局关于发布《体外诊断试剂分类规则》的公告(2021年第129号)
- 《6840体外诊断试剂分类子目录(2013版)》
- 《关于调整<6840体外诊断试剂分类子目录(2013版)>部分内容的公告》
- 2017年第226号附件《流式细胞仪配套用体外诊断试剂产品分类列表》
- 《免疫组化和原位杂交类体外诊断试剂产品分类列表》
- 《不作为医疗器械管理产品列表》
- 国家药监局关于调整《6840体外诊断试剂分类子目录(2013版)》部分内容的公告(2020年 第112号)
3.注册申报
- 《医疗器械监督管理条例》(中华人民共和国国务院令 739 号)
- 《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)
- 《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)
- 国家药品监督管理局关于实施《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》有关事项的通告(2021年第76号)
- 《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2021年第121号)
- 《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2021年第122号)
- 国家药监局关于发布医疗器械产品技术要求编写指导原则的通告(2022年第8号)
- 医疗器械产品技术要求编写指导原则(2022年第8号)
4.临床试验技术文件
- 国家药监局关于发布免于临床评价医疗器械目录的通告(2023年第33号)
医疗器械:
- 《医疗器械临床试验质量管理规范》
- 《医疗器械临床评价技术指导原则》
- 《医疗器械临床评价报告撰写技术指导原则》
- 《医疗器械临床试验设计指导原则》
- 《接受医疗器械境外临床试验数据技术指导原则》
- 《医疗器械临床试验数据递交要求注册审查指导原则》
体外诊断产品:
- 《医疗器械临床试验质量管理规范》
- 《体外诊断试剂临床试验技术指导原则》
- 《接受医疗器械境外临床试验数据技术指导原则》
- 《使用体外诊断试剂境外临床试验数据的注册审查指导原则》
- 《体外诊断试剂临床试验数据递交要求注册审查指导原则》
- 《来源于人的生物样本库样本用于体外诊断试剂临床试验的指导原则》
5.产品名称
- 《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第 19 号)
- 关于《医疗器械通用名称命名规则》的说明
- 国家药监局关于发布医疗器械通用名称命名指导原则的通告(2019年第99号)

DAMO开发者矩阵,由阿里巴巴达摩院和中国互联网协会联合发起,致力于探讨最前沿的技术趋势与应用成果,搭建高质量的交流与分享平台,推动技术创新与产业应用链接,围绕“人工智能与新型计算”构建开放共享的开发者生态。
更多推荐
 已为社区贡献2条内容
已为社区贡献2条内容






所有评论(0)